Dalla collaborazione con
ricercatori del CNR di Pisa, preparatori atletici e atleti delle
palestre New Point of Fitness e Scuola di Arti Marziali Fragale di
Pisa e’ stata di recente portata avanti l’idea di poter utilizzare
il sudore come campione analitico per la determinazione del lattato
e valutare il regime di allenamento degli atleti.
Lattato nel sudore per la valutazione della performance
La misura del lattato in tempo reale nel sudore durante
l’allenamento: fantasia o realta’?
Di: La Redazione
(Da un elaborato gentilmente concessoci dalla Dott.ssa Emilia
Bramanti)
Determinazione dell’acido lattico nel sudore: un metodo non
invasivo per la valutazione della performance sportiva.
Partecipanti: Emilia Bramanti1, Fabrizio Zucchini2, Massimo Onor1,
Ilaria Cecconi3, Stefania Banditelli3, Roberto Fragale4, Federico
Fragale4, Beatrice Guardati4
- Istituto di Chimica dei Composti Organo Metallici (ICCOM),
CNR, Area della Ricerca, Via G. Moruzzi 1 56124 Pisa
- Palestra New Point of Fitness, Via G. Carducci, 62 56017 San
Giuliano Terme, Loc. La Fontina e Via di Campaldo, 7 56122 Pisa.
- Nutrilab
- Scuola di Arti Marziali Fragale, Via Che Guevara n. 151,
Pisa
Ruolo dell’acido lattico in fisio-patologia
L’acido lattico (o lattato) e’ un prodotto della glicolisi
anaerobica. Si forma dal piruvato ad opera dell’enzima lattico
deidrogenasi (LDH) (Figura 1). L’acido lattico e’ presente nel
sangue e nei fluidi muscolari degli esseri umani e degli animali.
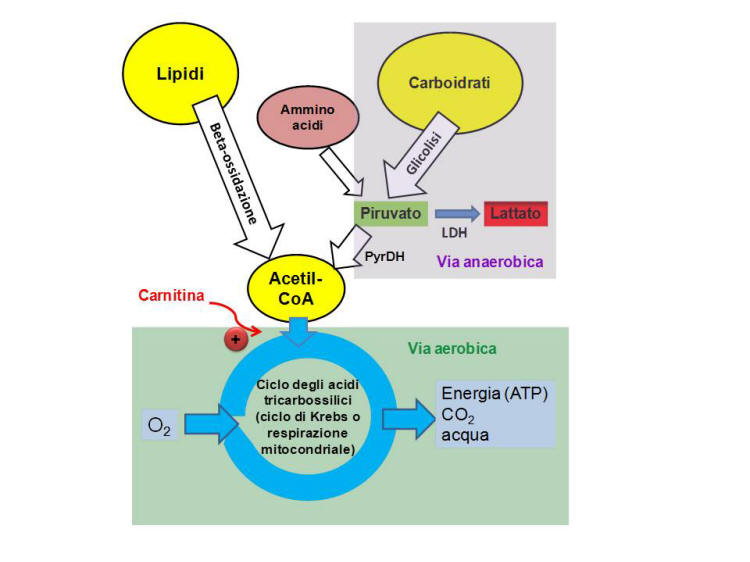
Figura 1. Schema della produzione di ATP in
condizioni aerobiche ed anaerobiche.
ATP= adenosina trifosfato; LDH= lattico deidrogenasi, PyrDH=piruvato
deidrogenasi.
Un uomo adulto normalmente attivo produce circa 120 grammi di
acido lattico al giorno; di questi 40 g (33%) sono prodotti dai
tessuti aventi un metabolismo esclusivamente anaerobico (retina e
globuli rossi), i rimanenti 80 g (67%) da altri tessuti (soprattutto
dal tessuto muscolare) in base all'effettiva disponibilità di
ossigeno. Nel fegato l’acido lattico viene riconvertito in glucosio
(ciclo di Cori) mentre il cuore e’ in grado di metabolizzarlo a
scopo energetico. Il rapporto lattato/piruvato riflette lo stato
cellulare aerobico/anaerobico. Quindi, il monitoraggio dei livelli
di lattato è un buon sistema per valutare il bilancio tra la
richiesta di ossigeno del tessuto e il suo utilizzo. L’aumento di
acido lattico (acidosi lattica) si puo’ avere in due condizioni:
- In caso di ipossia, ovvero carenza di ossigeno (acidosi
lattica di tipo A, veloce);
- In caso di eccessiva velocita’ della via glicolitica
anaerobica (acidosi lattica di tipo B, lenta).
Nell’acidosi lattica di tipo A la via aerobica, ovvero la via di
ossidazione del piruvato ad anidride carbonica ed acqua (parte verde
in Figura 1), viene bloccata per vari motivi. Questo accade in
seguito a errori congeniti del metabolismo ossidativo nella catena
della respirazione mitocondriale [1], nelle malattie cardiovascolari
(ischemia, ipossia polmonare, anemia) [2] e in altre malattie [3].
In particolare, i deficit di ossigeno (ipossia tissutale) sono tra
le cause piu’ comuni e spesso refrattarie dell’acidosi lattica e
comprendono problemi polmonari (bassa pressione parziale di
ossigeno), problemi circolatori (rilascio inefficace di ossigeno) e
problemi dell’emoglobina (bassa capacita’ di trasporto di ossigeno
dovuta a varie cause) [4].
Nell’acidosi lattica di tipo B, invece, la via anaerobica
(glicolisi, parte violetta di Figura 1) procede ad elevata velocita’
e causa bassi livelli di ATP e l’acido piruvico prodotto non viene
“smaltito” nella via aerobica, ma si accumula e viene ridotto ad
acido lattico dall’enzima lattico deidrogenasi. Questo si verifica
nel caso di esercizio fisico violento, nelle condizioni di
disaccoppiamento della fosforilazione ossidativa, con conseguente
accumulo di lattato, per esempio nella deficienza dell’enzima
piruvato deidrogenasi o deficienza di vitamina B1, quando si hanno
alti livelli di produzione di ATP dai lipidi o bassi livelli di
conversione del lattato a glucosio. Quest’ultimo problema si
verifica per malfunzionamento epatico, renale [4] o difetti nella
gluconeogenesi per effetto di farmaci o errori congeniti del
metabolismo [4].
L’acidosi metabolica si puo’ anche sviluppare nel corso di
trattamenti farmacologici e per esposizione a certe sostanze
chimiche [5] e in pazienti malati di cancro poiche’ le cellule
tumorali producono piu’ lattato delle cellule normali anche in
condizioni aerobiche. Il monitoraggio del lattato risulta importante
nel controllo del diabete [6], e durante la riabilitazione [7].
Acido lattico ed esercizio fisico
Nel muscolo durante esercizio fisico strenuo, il piruvato che si
forma da glucosio e glicogeno piuttosto che seguire la via aerobica
viene trasformato in acido lattico. Questo e’ riossidato e
parzialmente riconvertito a glucosio nel fegato durante il recupero
mediante il ciclo glucosio-alanina (ciclo di Cori). La sua
concentrazione nel plasma e’ generalmente inferiore a 1–2 mmol/L in
condizioni di riposo e aumenta oltre le 20 mmol/L durante intensa
attivita’ fisica a causa della variazione del metabolismo delle
cellule muscolari da aerobico ad anaerobico. Un tempo si pensava che
il meccanismo anaerobico lattacido fosse attivato per produrre ATP e
per soddisfare le aumentate richieste energetiche. In realta’ oggi
si sa che il ruolo del lattato come sorgente di energia e’ di minore
importanza. Invece e’ stato suggerito che la produzione di lattato
aumenti i livelli di concentrazione di NADH, ADP e fosfato e che
questi funzionino come attivatori della produzione aerobica di ATP
[8,9]. L'acido lattico, inoltre, rappresenta un forte stimolo per la
secrezione di ormoni anabolici come il GH ed il testosterone. Per
questo motivo esercizi con i pesi ad elevata intensità, intervallati
da pause non troppo lunghe, massimizzano il guadagno di massa
muscolare. Tuttavia, una volta raggiunto un certo livello di
concentrazione di lattato, interviene la spossatezza e si ha un
rapido declino della capacita’ all’esercizio [10]. Quindi, in
medicina dello sport, il livello di concentrazione del lattato viene
usato per controllare il massimo livello di prestazioni degli atleti
e il brusco incremento della quota di lattato presente nel sangue
viene detta soglia anaerobica del soggetto [8,11-13].
Nel muscolo sottosforzo la produzione di acido lattico è
massiccia soprattutto nelle fibre veloci o bianche che hanno un
metabolismo prevalentemente glicolitico anaerobico, e inferiore
nelle fibre rosse o resistenti, caratterizzate da un metabolismo
ossidativo aerobico. Atleti particolarmente brillanti nelle prove
anaerobiche lattacide come l'inseguimento su pista nel ciclismo ed i
400-1500 metri nell'atletica, producono oltre il 20% di acido
lattico in più rispetto ad una persona normale. A parita’ di
intensità di esercizio, la quantità di acido lattico prodotta è
inversamente proporzionale al grado di allenamento del soggetto. Ciò
significa che se un atleta ed un sedentario corrono alla stessa
velocità, quest'ultimo produce molto più acido lattico rispetto al
primo e lo smaltisce con maggiori difficoltà.
La soglia anaerobica è una stima della capacità di sostenere un
esercizio prolungato. Il suo valore indica la massima intensità di
esercizio corrispondente ad un livello costante nella concentrazione
ematica di lattato. La concentrazione ematica di lattato nel sangue
è normalmente di 1-2 mmoli/L a riposo ma durante uno sforzo fisico
intenso può raggiungere e superare le 20 mmol/L. Oltre la soglia
anaerobica la produzione di anidride carbonica (CO2) e la
ventilazione (atti respiratori al minuto) crescono rapidamente.
In molti casi è preferibile misurare la soglia anaerobica
rispetto al massimo consumo di ossigeno (VO2max) sia perche’ negli
atleti questo valore sale all'inizio degli allenamenti poi non
aumenta più, sia perche’ la soglia anaerobica in molte discipline di
endurance correla meglio con la prestazione, costituendo così un
miglior indice di potenza aerobica.
Nei soggetti non allenati la soglia anaerobica coincide
approssimativamente con il 55% del VO2max, in atleti di alto livello
la soglia anaerobica si raggiunge solo all'85% della VO2max.
Ad oggi esistono sostanzialmente tre metodi per misurare la
soglia anaerobica di uno sportivo. Questi metodi si basano:
- sulla misurazione dei parametri ventilatori;
- sulla deflessione della curva frequenza cardiaca/intensità
di esercizio (Test di Conconi);
- sulla determinazione della concentrazione del lattato nel
sangue.
La misurazione dei parametri ventilatori fornisce risultati
precisi. Tuttavia, tale metodica richiede l'uso di apparecchiature
molto costose (analizzatore dei gas respiratori). Il test di Conconi,
è il modo più semplice ed utilizzato per determinare la soglia
anaerobica di un atleta, ma essendo un test massimale non è adatto,
in quanto potenzialmente pericoloso, a valutare soggetti non
allenati o con problemi fisici. Inoltre la lettura del grafico di un
test Conconi talvolta non è così semplice e la sua corretta
interpretazione dipende dall'abilità ed esperienza del medico o
allenatore.
Per quanto riguarda la determinazione del lattato nel sangue,
questo metodo risulta essere invasivo e presenta una forte
variabilita’ biologica individuale.
Sebbene alcune tabelle riportino i valori medi di soglia
anaerobica (circa 4 mmol/l di lattato nel sangue) occorre
sottolineare che questi valori possono variare da soggetto a
soggetto e dipendono da vari parametri come la % percentuale di
massa muscolare, il tipo di massa muscolare (fibre bianche/fibre
rosse), il sesso, l’eta’.
Da quanto detto e’ importante poter determinare la quantità di
lattato atleti e soggetti che seguono un programma di allenamento
personalizzato, attraverso metodiche semplici, rapide, precise ed
accurate e possibilmente non invasive. Non ultima e’ di fondamentale
importanza la possibilita’ di misurare il lattato ripetutamente
sullo stesso soggetto durante l’allenamento dal momento che,
contrariamente a quello che si pensa, il lattato viene smaltito
rapidamente nel giro di 30 minuti - 1 ora dall’organismo nel ciclo
di Cori (citato sopra).
Metodi di determinazione del lattato.
Una pratica non invasiva: l’analisi del lattato nel sudore.
La determinazione del lattato si fa generalmente nel plasma o
nelle urine e nella maggior parte dei casi si basa su reazioni
enzimatiche [3,14],[15]. In alternativa il lattato viene determinato
mediante strumentazione di analisi chimica come la gas cromatografia
(GC) [16,17], la cromatografia liquida ad alta prestazione (high-performance
liquid chromatography, HPLC) [3,18-20] e la cromatografia liquida
accoppiata a spettrometria di massa (LC–MS) [21].
L’analisi nelle urine e’, di fatto, poco pratica e puo’ essere
effettuata al massimo prima e dopo l’allenamento. Inoltre non e’
stata stabilita ad oggi una precisa correlazione tra variazione di
acido lattico nelle urine e nel sangue. Senza dubbio ad oggi il
metodo piu’ comunemente impiegato e’ la determinazione del lattato
nel sangue capillare dal polpastrello delle dita o dal lobo
auricolare. L’analisi del sangue, tuttavia, presenta degli
svantaggi: i) e’ una pratica invasiva soprattutto se ripetuta
durante l’allenamento, ii) richiede rigide norme igieniche per
ridurre il rischio di infezioni e la presenza di uno staff medico,
iii) se non prelevato correttamente la misura nel sangue puo’ essere
falsata dalla presenza di sudore (che contiene una concentrazione di
lattato 10 volte superiore a quella del plasma), iv) il sangue
raccolto va “fissato” e analizzato rapidamente poiche’ col tempo
l’acido lattico nel campione aumenta a causa del metabolismo dei
globuli rossi. Per questi motivi lo sviluppo di metodi di misura del
lattato in mezzi alternativi al sangue suscita un grande interesse
in campo medico-sportivo.
Dalla collaborazione tra alcuni ricercatori del CNR di Pisa,
preparatori atletici e atleti delle palestre New Point of Fitness e
Scuola di Arti Marziali Fragale di Pisa, e’ stata di recente portata
avanti l’idea di utilizzare il sudore come campione analitico per la
determinazione del lattato per valutare il regime di allenamento
degli atleti.
L’uso del sudore come campione analitico risale agli anni ’70.
L’analisi dei metaboliti presenti nel sudore e’ sicura e semplice.
Ad oggi l’analisi degli elettroliti nel sudore rimane il "gold
standard" per la diagnosi della fibrosi cistica [22].
I vantaggi nell’uso del sudore sono la facilita’ di campionamento
e la possibilita’ di fare campionamenti frequenti, nonche’ l’assenza
di rischi di infezione. Inoltre, e’ stata ampiamente dimostrata la
correlazione tra la concentrazione di lattato nel plasma e nel
sudore [23-25].
Nei laboratori dell’Istituto di Chimica dei Composti
Organometallici del CNR Emilia Bramanti, Silvia Ghimenti, Massimo
Onor e Simona Biagi, hanno messo a punto un nuovo metodo per la
determinazione simultanea di lattato, piruvato, acido urico e
tirosina nel sudore.
Il metodo si basa su una comune tecnica di laboratorio
separativa, la cromatografia liquida HPLC e permette di analizzare
il campione di sudore raccolto senza alcun trattamento preliminare.
Il cromatografo liquido e’ uno strumento capace di separare i
costituenti di una miscela, e’ presente in tutti i laboratori di
analisi. Ogni analisi dura circa 20 minuti.
Il metodo e’ stato applicato all’analisi del sudore di 7 atleti
di kick boxing, raccolto nel corso di vari tipi di allenamento, e di
un soggetto di norma impegnato in allenamenti aerobici.
Per ogni determinazione occorrono da 20 a 500 mg di sudore.
Il sudore viene raccolto durante l’esercizio fisico, per un tempo
stabilito, su un disco di carta da filtro (a peso predeterminato)
tenuto in posizione nella zona lombare da un cerotto adesivo. Quindi
il disco bagnato dal sudore viene chiuso dentro un contenitore ed
analizzato subito o conservato a -20°C fino al momento dell’analisi.
Dalla differenza di peso del contenitore+filtro prima e dopo
raccolta del sudore e’ possibile misurare la quantita’ di sudore
raccolta nel tempo stabilito.
I valori basali di lattato, piruvato, acido urico e tirosina sono
stati misurati negli stessi soggetti a riposo raccogliendo il sudore
indotto da pilocarpina. Questa sostanza e’ un composto alcaloide di
origine vegetale che, applicata localmente sulla pelle mediante
apparecchio da ionoforesi, serve per indurre la sudorazione. Questa
fase di induzione del sudore dura 5 minuti e non è dolorosa. Solo in
alcuni casi essa può provocare un lieve formicolio sulla porzione di
pelle interessata (circa 5 cm2). Al termine dell'induzione,
l'avambraccio viene accuratamente sciacquato con acqua
demineralizzata ed asciugato. Sulla porzione di pelle su cui è stato
applicato l'elettrodo con pilocarpina viene posto un disco di carta
assorbente da laboratorio precedentemente pesato. Questo viene poi
avvolto da pellicola plastica trasparente e tenuto in posizione per
30 minuti, per raccogliere il sudore.
   
I valori a riposo di lattato, piruvato,
acido urico e tirosina negli 8 soggetti studiati sono riportati
nella Tabella 1.
Nella letteratura scientifica ci sono poche informazioni sulle
variazioni di acido urico durante allenamento e ancor meno sul
significato di queste variazioni. La tirosina e’ un amminoacido non
essenziale che deriva dalla fenilalanina ed e’ metabolicamente
importante perche’ e’ il precursore di vari ormoni. Tra questi la
tiroxina (un ormone tiroideo) e le catecolammine (dopamina,
noradrenalina e adrenalina). Non ci sono dati sulle variazioni di
tirosina nel sangue, ne’ nel sudore durante esercizio fisico e ci
sono pochi dati sulla concentrazione di tirosina nel sudore [26,27],
ma anche in questo caso il loro significato e’ sconosciuto. In
questa sede, quindi, focalizzeremo la nostra attenzione solo sulla
variazione di lattato e piruvato.
Tabella 1. Valori a riposo di lattato, piruvato, acido urico e
tirosina negli 8 soggetti studiati (sudorazione indotta da
pilocarpina) determinati mediante metodo cromatografico.
|
Soggetto |
Sesso, eta’, peso (kg) |
Lattato (mM) |
Piruvato (mM) |
Uric acid (mM) |
Tyrosine
(mM) |
|
1 |
M, 28, 77.0 |
78.2 |
2.46 |
0.0148 |
0.050 |
|
2 |
M, 32, 72.0 |
76.9 |
2.25 |
0.015 |
0.022 |
|
3 |
M, 39, 74.0 |
49.7 ± 5.7a |
0.68 ± 0.10 |
0.0086 ± 0.0006 |
0.136 ± 0.036 |
|
4 |
M, 22, 72.6 |
26.2 ± 2.9a |
0.56 ± 0.10 |
0.0038 ± 0.0002 |
0.023 ± 0.007 |
|
5 |
F, 19, 58.1 |
3.6 |
0.62 |
0.0042 |
0.284 |
|
6 |
F, 20, 47.1 |
18.4 |
0.25 |
0.0037 |
0.073 |
|
7 |
F, 28, 53.0 |
59.5 |
1.08 |
0.0341 |
0.291 |
|
8 |
F, 43, 62.5 |
46.1 ± 4.8 a |
1.86 ± 0.20 |
0.012 ± 0.0003 |
0.056 ± 0.015 |
M=maschio; F=femmina. a N=3 misure effettuate
in giorni diversi.
I valori trovati a riposo sono in buon accordo con quelli riportati
nella letteratura scientifica [28-31].
Sette degli 8 soggetti erano atleti di kick boxing e sono stati
studiati nel corso di allenamenti di vario tipo (tabella 2). Tutti i
soggetti erano digiuni da almeno 2 ore. Essendo il sudore campionato
per il tempo indicato in tabella, i valori di lattato e piruvato
trovati rappresentano la composizione media rispetto alle attivita’
considerate.
Gli allenamenti di tipo A, B e C erano allenamenti volti al
potenziamento ed all’aumento di massa muscolare. L’allenamento di
tipo D era un allenamento di tipo aerobico, cosi’ definito in base
al mantenimento della frequenza cardiaca nell’intervallo stabilito
per sesso ed eta’ del soggetto. L’allenamento di kick boxing (tipo
E) si presta particolarmente bene ad osservare le variazioni di
lattato perche’ in una sessione di allenamento relativamente breve
(45 min) si susseguono una serie di attivita’ eterogenee dal punto
di vista aerobico-anaerobico. Inoltre, dato che non esistono
programmi di allenamento ben stabiliti, la valutazione di parametri
metabolici di questi soggetti potrebbe rivelarsi fondamentale per
migliorare le loro prestazioni atletiche.
   
Procedendo, quindi, con la raccolta di campioni di sudore prima
dell’allenamento (a riposo), a intervalli regolari durante
l’allenamento e nella fase di recupero, è possibile costruire la
curva della concentrazione di acido lattico al procedere
dell’allenamento. Nelle prestazioni di breve durata il valore di
lattato può essere anche un indice della frazione di utilizzo di
fibre muscolari a contrazione veloce rispetto allo stesso soggetto
come spia degli adattamenti indotti dall'allenamento.
Tabella 2. Descrizione degli allenamenti effettuati durante varie
serie di campionamenti del sudore.
|
Tipo di. allenamento |
Soggetti coinvolti |
Descrizione |
|
A |
3, 4 |
a)
riscaldamento (10 min)
b)
addominali (10 ripetizioni x 4 serie, 10 min)
c)
dorsali (lat machine, 10 ripetizioni x 4 serie, 15 min)
d)
dorsali (pull, 10 ripetizioni x 4 serie, 10 min)
e)
recupero attivo (cyclette, 5 min) |
|
B |
3, 4 |
a)
riscaldamento (5 min)
b)
addominali (10 min)
c)
pettorali (panca piana, 15 min)
d)
pettorali (panca inclinata + croci, 15 min)
e)
dorsali (pull, 10 min)
f)
recupero attivo (cyclette, 5 min) |
|
C |
3 |
a)
riscaldamento (10 min)
b)
squat (15 min)
c)
glutei alla spalliera (15 min)
d)
leg extension (10 min)
e)
leg curl (10 min)
f)
polpacci (7 min)
g)
recupero attivo (cyclette, 10 min) |
|
D |
8
(3 repliche) |
a)
riscaldamento (tapis roulant + top, 16 min)
b)
abduttori, pettorali, glutei (16 min)
c)
pettorali, dorsali, glutei (20 min)
d)
pressa, addominali (15 min) |
|
E |
1, 2, 3, 4, 5, 6, 7 |
a)
riscaldamento (10 min);
b)
Pao (PK) 3 riprese da 2 min, 1 min di recupero tra una e
l’altra (3x2’, 1’recovery, 9 min totali) oppure 3
riprese da 3 min, 1’30’’ di recupero (3x3’, 1’30’’
recovery, 13 min 30 s totale);
c)
Ripetizioni (Boxing bag BB) 3 riprese da 2 min, 1 min di
recupero (3x2’, 1’recovery, 9 min totali);
d)
Ring 3 riprese da 2 min, 1 min di recupero (3x2’, 1’recovery,
9 min totali). |
La Figura 2 mostra l’andamento della
concentrazione di lattato negli 8 soggetti sottoposti alle diverse
sessioni di allenamento.
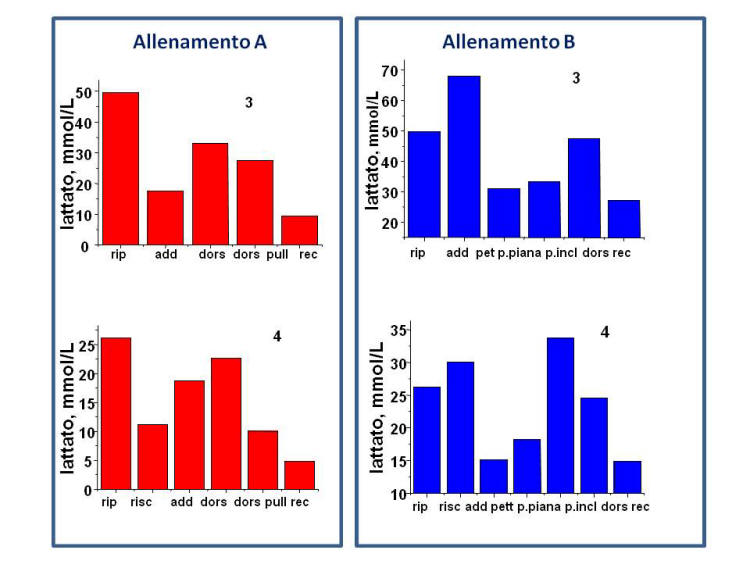
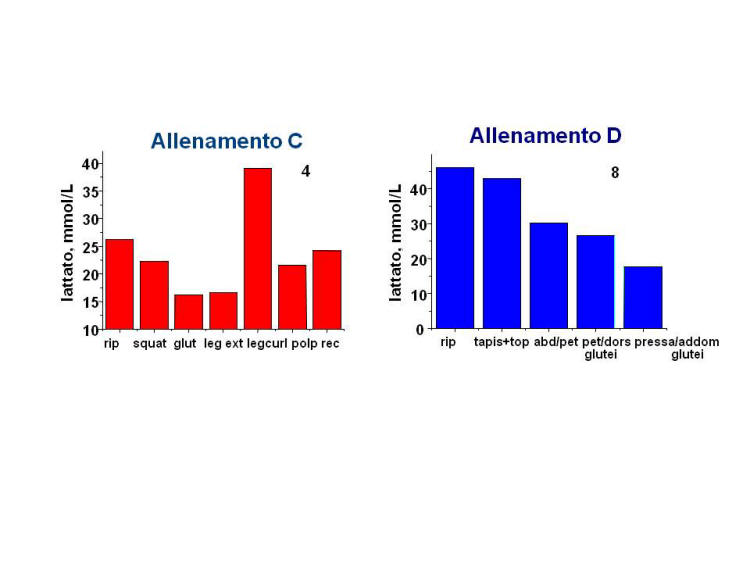
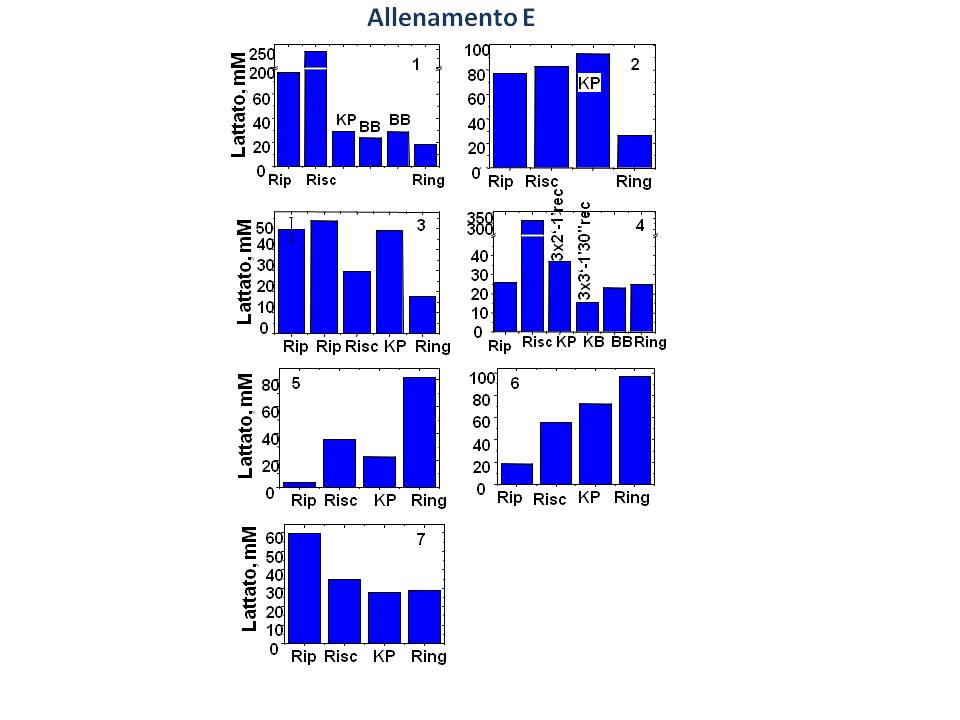
Figura 2. Andamento dei valori di
concentrazione di lattato negli 8 soggetti sottoposti alle diverse
sessioni di allenamento descritte in Tabella 2.
Sebbene il lattato nel sudore sia anche prodotto dalle ghiandole
sebacee [32], le variazioni significative che si osservano durante
l’esercizio fisico suggeriscono che questo valore puo’ essere
utilizzato come indicatore per stimare le condizioni fisiche.
Nel corso di allenamenti di potenziamento (di tipo A, B e C) i
valori di lattato sono tipicamente piu’ bassi rispetto ai valori
individuali di lattato a riposo e solo per alcune attivita’
aumentano. Considerato che le varie attivita’ prevedono una sequenza
di 10-12 ripetizioni in 3-4 serie e 1-2 minuti di recupero tra una
serie e l’altra, e che il sudore viene raccolto per tutta la durata
della singola attivita’, il valore di lattato che misuriamo
rappresenta un valore medio che e’ il risultato della sua sintesi e
degradazione.
   
In particolare, durante il recupero tra una serie e l’altra
parte, dell’acido lattico entra nel ciclo di Cori per il ripristino
di glicogeno nel fegato, parte viene riconvertito ad acido piruvico
(Figura 1) ed entra nella via aerobica (ciclo di Krebs)
ripristinando le riserve di ATP. Questi meccanismi sono, tuttavia,
ancora oggi controversi.
In questo tipo di allenamento, sebbene si raggiungano intensita’
di esercizio molto elevate, queste vengono svolte per un periodo di
tempo limitato e sono seguite da periodi di recupero relativamente
lunghi. Di fatto l’allenamento adottato in questi soggetti e’ di
tipo intervallato (interval training) con lavori sopramassimali
intervallati da periodi di recupero. E’ verosimile ipotizzare che in
questo tipo di attivita’ la liberazione di energia provenga da
processi anaerobici durante lo sforzo, ma che durante il recupero
sia attivato il processo ossidativo aerobico.
   
L’allenamento di tipo D consta di superserie svolte in regime
aerobico (frequenza cardiaca intorno a 130 bpm per il soggetto 8) e
il livello di lattato nel sudore diminuisce nel corso
dell’allenamento, per effetto della diluizione dovuta ad aumento
della velocita’ di sudorazione. In questo tipo di allenamento e’
verosimile ipotizzare che il metabolismo muscolare sia
prevalentemente ossidativo.
Quanto osservato e’ in accordo con le conoscenze di base secondo
le quali non si ha accumulo di lattato in condizioni di esercizio
aerobico a stato stazionario e durante sforzi intensi e brevi (5-10
s), sostenuti esclusivamente da energia proveniente da fosfati
energetici (ATP e fosfocreatina), seguiti da recupero che, in questo
tipo di esercizi, e’ breve [24,33].
L’allenamento di tipo E riveste un particolare interesse dal
momento che prevede per ogni attivita’ 3 serie ad elevata intensita’
prolungate per almeno 2 minuti (KP, BB, ring) tipicamente con 1
minuto di recupero tra una serie e l’altra.
Per alcuni soggetti la concentrazione assoluta di lattato nel
sudore aumenta durante il riscaldamento (nei soggetti 1, 4, 2, 5 e
6), durante pao (KB in figura 2, nei soggetti 4, 5 e 6) e
allenamento sul ring (nei soggetti 5 e 6). In altri casi la
concentrazione di lattato nel sudore diminuisce verosimilmente a
causa della diluizione dovuta ad aumento della velocita’ di
sudorazione: a parita’ di tempo di campionamento la concentrazione
di lattato nel sudore raccolto e’ minore se il soggetto suda di piu’
(sweating rate) perche’ diluita in un volume maggiore di sudore
prodotto.
   
La misura assoluta di lattato e’ comunque importante per
stabilire il tipo di allenamento. Una prova di questo e’ il test
condotto sul soggetto 4 (Figura 2), un atleta che presenta sul ring
valori di lattato paragonabili a quelli rilevati a riposo. Variando
in questo soggetto le modalita’ di esecuzione del pao, 3 serie da 2
minuti con 1 min di recupero oppure 3 serie da 3 minuti con 1’30’’
di recupero, si e’ osservata una variazione significativa della
concentrazione di lattato nel sudore con livelli nel primo caso
molto superiori al valore osservato sul ring e, nel secondo caso,
paragonabili a quelli osservati durante combattimento sul ring.
Chiaramente, manipolando opportunamente i periodi di lavoro e
recupero e’ possibile allenare uno specifico sistema esoergonico
(aerobico e/o anaerobico, immediato, a breve o lungo termine) per
ottimizzare la performance in gara.
Il rapporto lattato/piruvato e produzione di lattato nell’unita’
di tempo (mmol/min): due parametri importanti.
Come si osserva dai risultati riportati nel paragrafo precedente,
sia i valori di lattato a riposo che quelli durante esercizio fisico
possono variare molto tra soggetto e soggetto e, nello stesso
soggetto, a seconda del tipo di esercizio eseguito. Questa
variabilita’ individuale e’ dovuta al sesso, eta’, indice di massa
corporea, massa muscolare, composizione del muscolo in termine di
fibre bianche/fibre rosse e, come gia’ detto sopra, dalla velocita’
di sudorazione (sweating rate [34]). Questo problema potrebbe essere
in parte controllato ricorrendo ad un campionamento piu’ frequente e
rapido in cui sia possibile raccogliere in tempi molto brevi (10
sec) un volume minimo di sudore (0.1 mL per esempio). Questo tipo di
campioni, analizzati “sul posto” durante gli allenamenti,
permetterebbero di “calibrare” ad hoc la preparazione atletica in
tempo reale.
Un parametro che tiene conto della sweating rate e che, quindi,
permette il confronto dei risultati ottenuti in diversi tipi di
allenamento dallo stesso soggetto e’ il rapporto millimoli di
lattato prodotte per minuto (mmmol/min). Questo indica la quantita’
di lattato immessa in circolo normalizzata rispetto alla velocita’
di sudorazione e viene calcolato sulla base del tempo di
campionamento, della concentrazione di lattato trovata e della
quantita’ totale in mg di sudore prodotta durante il tempo di
campionamento.
L’altro parametro da considerare e’ il rapporto lattato/piruvato.
Abbiamo visto che mentre le concentrazioni di lattato e piruvato
possono fluttuare nello stesso soggetto a riposo del 15-20% da
giorno a giorno, il rapporto lattato/piruvato rimane relativamente
costante (coefficiente di variazione percentuale= 2-10%).
La Figura 3 riporta i valori del rapporto lattato/piruvato a
riposo del soggetto 8 e riportati nel corso di 3 allenamenti
“aeobici” analoghi, di 45 minuti ciascuno, effettuati dallo stesso
soggetto in 3 giorni diversi. Mentre le mmol di lattato prodotte per
minuto possono variare da giorno a giorno, il rapporto
lattato/piruvato a parita’ di tipo di allenamento si mantiene
costante. Questo rapporto rappresenta, inoltre, un parametro
attendibile per valutare lo stato metabolico aerobico/anaerobico e
il switch da metabolismo aerobico ad anaerobico e viceversa.
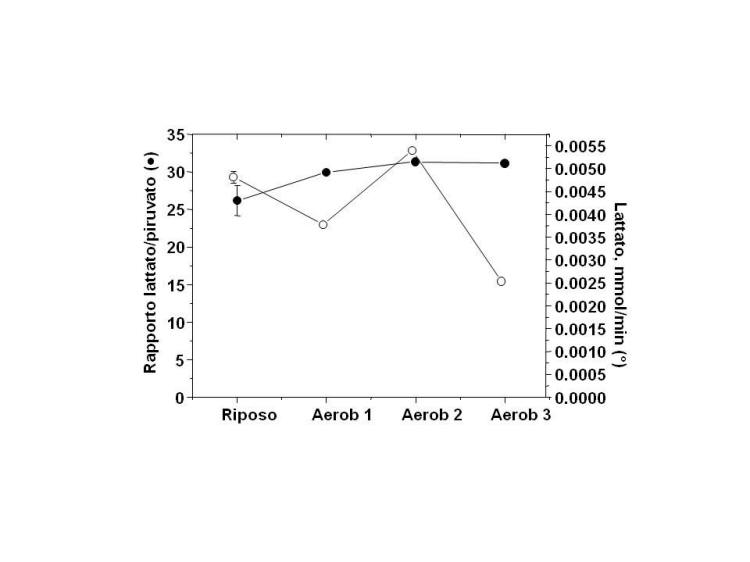
Figura 3. Valori del rapporto
lattato/piruvato a riposo e durante 3 allenamenti “aeobici” di 45
minuti ciascuno (soggetto 8).
La figura 4 mostra
le variazioni del rapporto lattato/piruvato e le mmol/min di lattato
prodotte negli 8 soggetti studiati nel corso dei 5 diversi
allenamenti.
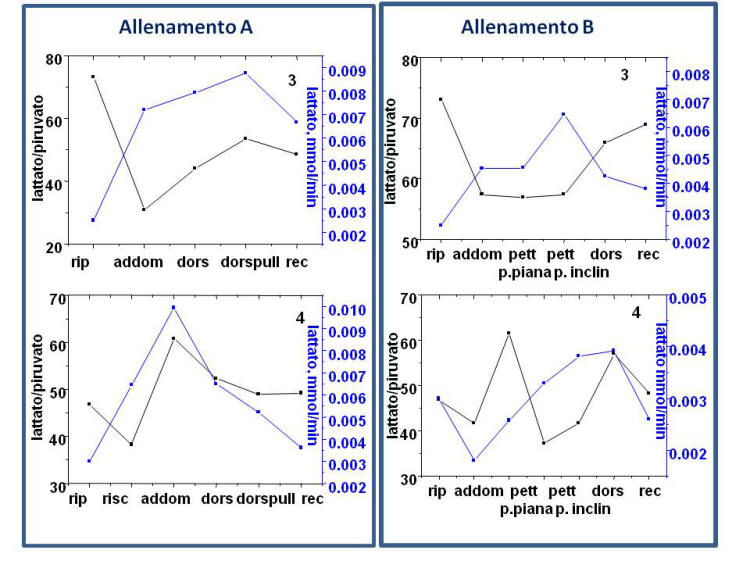
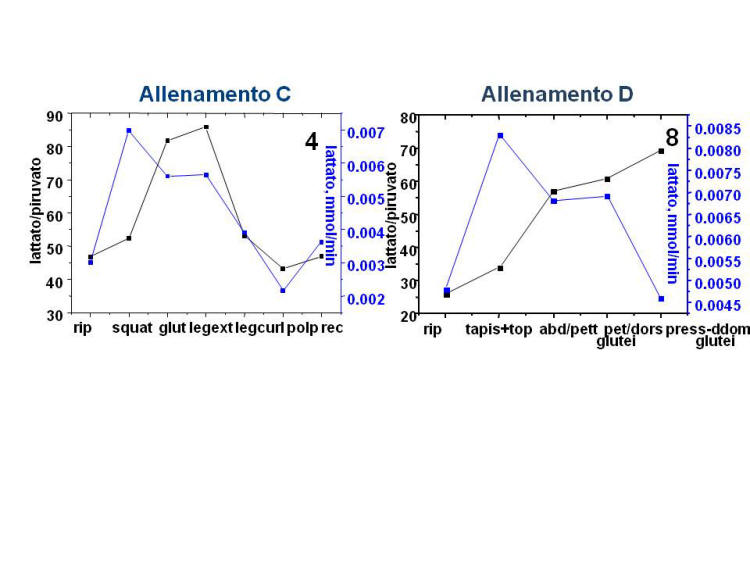
Figura 4. Andamento del rapporto
lattato/piruvato e delle mmol/min di lattato prodotte negli 8
soggetti studiati nel corso dei 5 diversi allenamenti.
In tutte le tipologie di allenamento l’andamento delle mmol di
lattato prodotte per minuto ha un tipico andamento “a campana”.
Questo puo’ essere spiegato con un aumento della produzione di
lattato nella prima parte della seduta di allenamento per
attivazione della degradazione del glicogeno muscolare e della
glicolisi a causa di una limitata disponibilita’ di ossigeno nel
muscolo. Successivamente il lattato nel flusso sanguigno e, quindi,
nel sudore diminuisce per effetto sia della riconversione a piruvato
e re-immissione nella respirazione mirìtocondriale (via aerobica),
sia della sua riconversione a glucosio nel fegato per attivazione
della gluconeogenesi (ciclo di Cori). E’ ben noto, infatti, che la
glicolisi anaerobica e’ fondamentale i) per fornire energia nelle
fibre di tipo IIb anaerobiche, ii) nei momenti iniziali
dell’esercizio prima che il flusso sanguigno, stimolato
dall’esercizio stesso, aumenti nei muscoli [35]. E’ stato anche
ipotizzato che l’aumento di lattato stesso e l’aumento di NADH, ADP
e fosfato contribuiscano ad attivare la produzione aerobica di ATP
[8,9]. Proseguendo nell’esercizio fisico il glicogeno muscolare si
esaurisce e il muscolo deve far fronte alle richieste energetiche
con la ossidazione degli acidi grassi e con la respirazione
mitocondriale.
Da sottolineare che le variazioni si lattato prodotto/min sono
soggettive, dipendono, a loro volta, e possono dare indicazioni
sulla composizione della massa muscolare dell’individuo in termini
di fibre rapide o lente e possono indicare l’efficacia della
procedura del recupero [36]. I risultati di figura 3 sono in accordo
con quanto riportato da Newsholme e Leech [35].
Le variazioni del rapporto lattato/piruvato presentano un
andamento piu’ complesso e non necessariamente presentano lo stesso
andamento delle variazioni di lattato. Il rapporto lattato/piruvato
durante esercizio fisico aumenta quando il lattato aumenta rispetto
al piruvato e diminuisce quando piruvato aumenta rispetto al
lattato. Ovviamente dipende dalle quantita’ di lattato e piruvato
prodotte e consumate (Figura 1) [7]. Abbiamo piu’ volte detto che il
lattato aumenta in conseguenza dell’attivazione della via
anaerobica. Il piruvato aumenta per:
- forte attivazione della glicolisi stessa;
- la riconversione di lattato a piruvato;
- il catabolismo di alcuni amminoacidi (alanina, cisteina e
serina)
Inoltre, l’attivazione del metabolismo lipidico che si ha durante
esercizio fisico e digiuno, per esempio, inibisce l’enzima piruvato
deidrogenasi bloccando l’utilizzo del piruvato nella respirazione
mitocondriale.
Nell’allenamento di tipo E il rapporto lattato/piruvato aumenta
nei soggetti 1, 2, 3, 4, 5, e 7 in corrispondenza di attivita’
intense come pao (KB), ripetizioni al sacco (BB) e, in alcuni casi
nei combattimenti sul ring.
Anche nell’allenamento di tipo aerobico (D, soggetto 8) si e’
osservato un aumento del rapporto L/P.
E’ interessante sottolineare che nel soggetto 4 il pao e’ stato
fatto in due condizioni: 3 riprese da 2 min ciascuno con 1 minuto di
recupero tra una ripresa e l’altra oppure 3 riprese da 3 minuti
ciascuno con 1 minuto e 30 s di recupero. In quest’ultima
condizione, il rapporto L/P era molto piu’ basso e inferiore persino
al valore di riposo e, corrispondentemente, piu’ basse anche le mmol
di lattato prodotte per minuto.
In alcuni soggetti e durante alcuni allenamenti il rapporto L/P
diminuisce al di sotto del valore di riposo. Questo puo’ essere
dovuto a valori individuali elevati del rapporto L/P a riposo
(soggetti 3 e 6). Tuttavia, a fronte di un incremento del lattato
prodotto, l’accumulo di piruvato e’ ancora maggiore a causa per
esempio, di un’attivazione maggiore della lipolisi in questi
soggetti.
La misura del lattato in tempo reale nel sudore durante
l’allenamento: fantasia o realta’?
La maggior parte dei lavori pubblicati sulla determinazione del
lattato nel sudore si basano su saggi enzimatici [14,34,37-39], su
biosensori amperometrici [12,24,29,40], su un biosensore
elettrochemiluminescente (ECL) [41].
Di recente Emilia Bramanti, Fabrizio Zucchini e Massimo Onor hanno
messo a punto due brevetti per la determinazione di acido lattico in
fluidi biologici, particolarmente adatti all’analisi nel sudore. I
metodi di analisi descritti nei brevetti impiegano reagenti non
enzimatici a basso costo che possono essere utilizzati con
apparecchiature comunemente presenti in laboratorio sia
implementabili ed adattabili a sistemi monouso e dispositivi
portatili per la misurazione rapida, non invasiva e ripetuta del
lattato.
Il metodo proposto e’ stato applicato alla determinazione di
acido lattico nel sudore di atleti sottoposti a esercizio fisico ed
ha fornito risultati confrontabili con quelli ottenuti mediante il
metodo HPLC.
Queste nuove promettenti metodiche, una volta opportunamente
commercializzate, potrebbero essere applicate “sul campo” durante
gli allenamenti perche’ veloci, a basso costo e non invasive.
L’analisi del lattato puo’ essere utile durante le varie fasi di
allenamento di un atleta per la programmazione dell’allenamento
stesso e per la scelta dei ritmi gara. Dopo una competizione questo
metodo permettere di misurare rapidamente il valore di lattato,
l’andamento della concentrazione di lattato nella fase di recupero
e, quindi, valutare la capacità di smaltimento del lattato stesso.
RIFERIMENTI BIBLIOGRAFICI
[1] F.G. Debray, G.A. Mitchell, P. Allard, B.H. Robinson, J.A.
Hanley, M. Lambert, Clinical Chemistry 53 (2007) 916.
[2] W.A. Neill, P.E. Jensen, G.B. Rich, J.D. Werschkul, The Journal
of Clinical Investigation 48 (1969).
[3] J.B. Ewaschuk, G.A. Zello, J.A. Naylor, D.R. Brocks, Journal of
Chromatography B-Analytical Technologies in the Biomedical and Life
Sciences 781 (2002) 39.
[4] F.C. Luft, Journal of the American Society of Nephrology 12
(2001) S15.
[5] G. Liamis, H.J. Milionis, M. Elisaf, Drug Safety 33 (2010) 371.
[6] J.P. Talasniemi, S. Pennanen, H. Savolainen, L. Niskanen, J.
Liesivuori, Clinical Biochemistry 41 (2008) 1099.
[7] O. Faude, W. Kindermann, T. Meyer, Sports Medicine 39 (2009)
469.
[8] K. Sahlin, A. Katz, J. Henriksson, Biochem. J. 245 (1987).
[9] A. Katz, K. Sahlin, J Appl Physiol. 65 (1988).
[10] T.E. Graham, P.K. Pedersen, B. Saltin, J Appl Physiol. 63
(1987).
[11] K. Sahlin, S. Cizinsky, M. Warholm, J. Hoberg, European Journal
of Applied Physiology and Occupational Physiology 64 (1992) 228.
[12] K. Mitsubayashi, M. Suzuki, E. Tamiya, I. Karube, Analytica
Chimica Acta 289 (1994) 27.
[13] G.A. Noy, A.L.J. Buckle, K.G.M.M. Alberti, Clin. Chim. Acta 89
(1987).
[14] Y. Kondoh, M. Kawase, S. Ohmori, European Journal of Applied
Physiology and Occupational Physiology 65 (1992) 88.
[15] H.U. Bergmeyer, in, Vch Pub, 1986.
[16] Y. Inoue, T. Shinka, M. Ohse, H. Ikawa, T. Kuhara, Journal of
Chromatography B-Analytical Technologies in the Biomedical and Life
Sciences 838 (2006) 37.
[17] M.J. Paik, E.Y. Cho, H. Kim, K.R. Kim, S. Choi, Y.H. Ahn, G.
Lee, Biomedical Chromatography 22 (2008) 450.
[18] S. Okubo, F. Mashige, M. Omori, Y. Hashimoto, K. Nakahara, H.
Kanazawa, Y. Matsushima, Biomedical Chromatography 14 (2000) 474.
[19] G. Cevasco, A.M. Piatek, C. Scapolla, S. Thea, Journal of
Chromatography A 1218 (2011) 787.
[20] K. Pailla, F. Blonde-Cynober, C. Aussel, J.P. De Bandt, L.
Cynober, Clinical Chemistry 46 (2000) 848.
[21] E.J. Franco, H. Hofstetter, O. Hofstetter, Journal of
Pharmaceutical and Biomedical Analysis 49 (2009) 1088.
[22] P.M. Tocci, R.M. McKey, Clin. Chem. 22 (1976).
[23] R.L. Altman, D.S. Dittmer (R.L. Altman, D.S. Dittmer(R.L.
Altman, D.S. Dittmers), Blood and Other Body Fluids. Federation of
American Societies for Experimental Biology, Washington, D.C., 1961.
[24] M.H. Faridnia, G. Palleschi, G.J. Lubrano, G.G. Guilbault,
Analytica Chimica Acta 278 (1993) 35.
[25] D.A. Sakharov, M.U. Shkurnikov, M.Y. Vagin, E.I. Yashina, A.A.
Karyakin, A.G. Tonevitsky, Bulletin of Experimental Biology and
Medicine 150 (2010) 83.
[26] P.H. Gitlitz, F.W. Sunderman, D.C. Hohnadel, Clinical Chemistry
20 (1974) 1305.
[27] N. Liappis, H. hungerland, American Journal of Clinical
Nutrition 25 (1972) 661.
[28] Ciba-Geigy (Ciba-Geigy),Ciba-Geigys), Tavole Scientifiche Geigy,
Vicenza, 1983.
[29] J. Kulys, L.Z. Wang, N. Daugvilaite, Analytica Chimica Acta 265
(1992) 15.
[30] M.L. Jin, Q. Dong, R. Dong, W.R. Jin, Electrophoresis 22 (2001)
2793.
[31] L.C. Diem K (L.C. Diem K),L.C. Diem Ks), Scientific tables,
J.R. Geigy and S A,, Basle, Switzerland, 1970.
[32] R.S. Gordon, R.H. Thompson, J. Muenzer, D. Thrasher, Journal of
Applied Physiology 31 (1971) 713.
[33] N. Shimojo, K. Fujino, S. Kitahashi, M. Nakao, K. Naka, K.
Okuda, Clinical Chemistry 37 (1991) 1978.
[34] M.J. Buono, N.V.L. Lee, P.W. Miller, Journal of Physiological
Sciences 60 (2010) 103.
[35] E.A. Newsholme, A.R. Leech, in Wiley (Editor), Wiley,
Chichester, 1992.
[36] K.K. MCARDLE, in C.E. Ambrosiana (Editor), Milano, 2001.
[37] J.M. Green, P.A. Bishop, I.H. Muir, R.G. Lomax, European
Journal of Applied Physiology 82 (2000) 230.
[38] J.M. Green, P.A. Bishop, I.H. Muir, J.R. McLester, H.E. Heath,
International Journal of Sports Medicine 21 (2000) 556.
[39] L.S. Lamont, J Appl Physiol. 62 (1987).
[40] G.G. Guilbault, G. Palleschi, G. Lubrano, Biosensors &
Bioelectronics 10 (1995) 379.
[41] X. Cai, J.L. Yan, H.H. Chu, M.S. Wu, Y.F. Tu, Sensors and
Actuators B-Chemical 143 (2010) 655.
----------------------------------------------------
1 - Le fibre muscolari si distinguono in:
• Lente (tipo I, slow o S), sviluppano
bassa forza ma sono molto resistenti alla fatica
• Rapide di tipo IIb (fast fatiguable, FF) sviluppano forze
molto elevate ma si affaticano rapidamente
• Rapide di tipo IIa (fast fatigue resistant FR), sviluppano
meno forza delle IIb ma sono piu resistenti
Le IIa e IIb sono innervate da motoneuroni
molto grandi (motoneuroni alfa); le I da motoneuroni piccoli.
Le fibre rapide IIb hanno un metabolismo prevalentemente
glicolitico anaerobico. Le fibre di tipo IIa hanno un
metabolismo sia glicolitico che aerobico. Le fibre di tipo I
hanno un metabolismo prevalentemente aerobico, hanno un gran
numero di mitocondri (per questo sono rosse) e una maggiore
densita’ di capillari.
L’allenamento anaerobico aumenta la percentuale di fibre di tipo
II, mentre l’allenamento aerobico aumenta la percentuale delle
I. Alcuni studi indicano che le fibre IIa, che sono di
transizione tra le IIb e le I, possono assumere caratteristiche
simili alle IIb o alle I a seconda dell’allenamento (adattamento
metabolico).
|